Illumina-RNA建库试剂盒
产品介绍
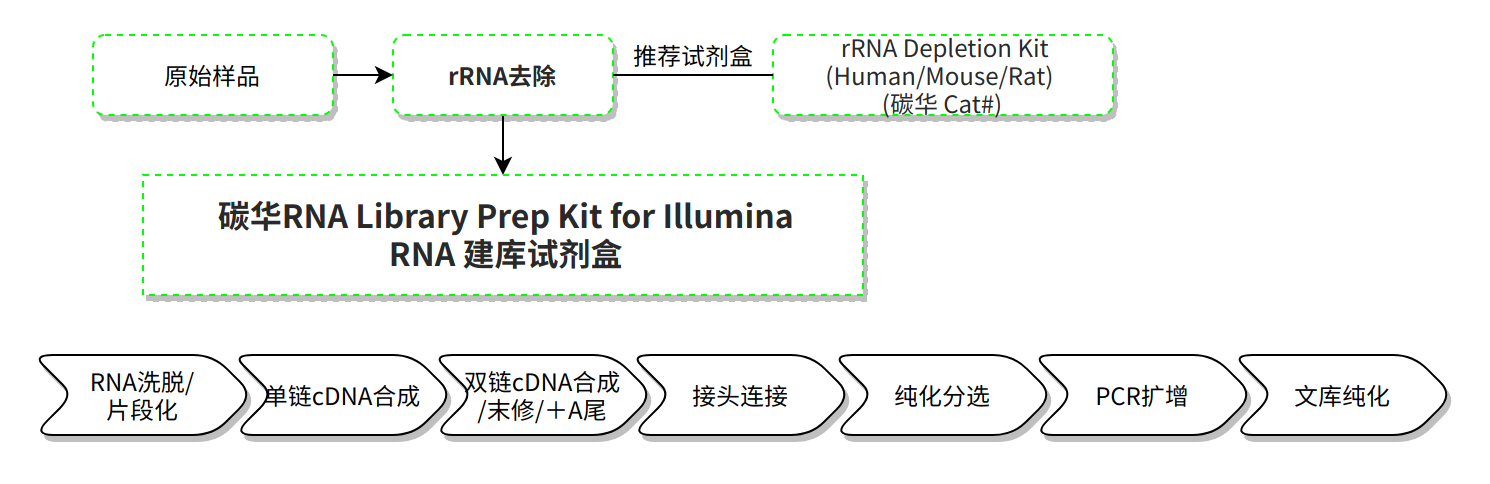
Illumina-RNA建库试剂盒是用于Illumina测序平台的RNA测序文库构建试剂盒,包含RNA片段化试剂,反转录试剂,常规和链特异性ds-cDNA合成试剂,以及文库扩增试剂。二链合成模块配有两种Buffer,客户可根据需要进行常规建库或链特异性建库。其中链特异性二链合成Buffer中将dTTP替换为dUTP,使cDNA第二链中掺入dUTP,而本试剂盒使用的高保真DNA聚合酶无法扩增含尿嘧啶的DNA模板,实现链特异性。提供的所有试剂都经过严格的质量控制和功能验证,最大程度上保证了文库构建的稳定性和重复性。
产品优势
■ 操作流程简便,可实现RNA样本的快速文库构建。
■ 文库转化率高,适用于极低起始量样本文库的高效转化。
■ PCR富集过程中保真度高,不存在碱基偏好性。
产品组分
|
名称 |
96T |
|
2× Frag/Prime Buffer |
960μL |
|
1st Strand Enzyme Mix 3 |
192μL |
|
1st Strand Buffer 3 |
672 μL |
|
2nd Strand Buffer 2 (dNTP) |
4×600 μL |
|
2nd Strand Buffer 2 (dUTP) |
4×600 μL |
| 2nd Strand Enzyme Master Mix |
480 μLl |
| 2nd Strand Enzyme Super Mix 2 | 2×720 μL |
| Rapid Ligation Buffer 4 | 4×600 μL |
| Rapid Ligation Buffer 4 | 480 μ |
| PCR Primer Mix 4 | 480 μ |
| 2×HF Amplification Mix | 4×600 μL |
注意事项
1.关于运输与保存方法:干冰运输。-20℃保存。有效期1年。
2.关于操作
■ 为了您的安全和健康,请穿实验服并戴一次性手套操作。
■ 请于使用前将试剂盒各组分置于室温解冻。解冻后上下颠倒数次充分混匀,短暂离心后置于冰上待用。
■ 推荐在带热盖的PCR仪中进行各步骤反应,使用前应预热PCR仪至反应温度附近。
■ 请使用无RNase污染的耗材,并对实验区域定期进行清理,推荐使用ThermoFisher公司的RNAZapTM高效核酸去除喷雾去除RNA酶污染。
■ PCR产物因操作不当极容易产生气溶胶污染,进而影响实验结果准确性。推荐将PCR反应体系配制区和PCR产物纯化检测区进行强制性的物理隔离;配备文库构建专用移液器等设备;定时对各实验区域进行清洁(推荐使用ThermoFisher公司的DNAZapTM高效核酸去除喷雾),以保证实验环境的洁净度。
■ 本产品仅作科研用途!
3.关于接头连接 (Adapter Ligation)
■ 试剂盒标配接头:Index Kit V2 for Illumina。
■ 我们建议选用高质量的商业化接头。如客户使用自制接头,请委托具有NGS引物合成经验的公司,并备注需进行严格的防污染控制。此外,进行接头退火操作时,请在超净台完成。每次只操作一种接头,防止交叉污染。
■ 使用接头时,请提前将接头取出放在4°C或冰盒上解冻;在室温操作时,实验室温度最好不要超过25°C,防止接头解链。
■ 建库过程中,接头浓度过高或过低都会导致建库成功率变低。本试剂盒操作方案中,所加入的接头体积固定为5 μL,请根据初始的RNA投入量,参考表1对接头进行稀释。本公司接头原始浓度均为15 μM,接头稀释液请选择0.1×TE buffer,稀释过的接头可在4°C保存48小时。
表1 Input Total RNA量与接头使用浓度推荐表
无法复制加载中的内容
4.关于文库扩增 (Library Amplification)
■ 本试剂盒中的文库扩增组分由本公司第二代高保真DNA聚合酶所组成,在第一代的基础上,大大增强了扩增的均一性,即使是低拷贝的基因,也能进行无偏好性地扩增。
■ 如果您使用 Indexed Adapter(也称为长接头、大Y接头),可使用本试剂盒提供的引物 Primer mix 进行扩增;如果使用的是“短接头”或者叫“小Y接头”,则需要使用 Index Primers 进行扩增,加上相应的 Index。
■ 文库扩增步骤需要严格控制扩增循环数。循环数不足,将导致文库产量低;循环数过多,又将导致文库偏好性增加、重复度增加、嵌合产物增加、扩增突变积累等多种不良后果。表2列举了使用本试剂盒进行文库扩增,Input Total RNA 量与相应扩增循环数的推荐。
■ 表2中推荐的循环数可满足绝大多数建库需求,若您的样本质量较差(如降解严重的FFPE样本),可根据实际情况适当增加循环数。mRNA建库时请特别注意,由于不同物种和组织所提取的 Total RNA中,mRNA的含量差异较大,实验中需根据建库起始量、物种类型及样本处理情况适当调整扩增循环数。
表 2 Input Total RNA 量与扩增循环数推荐表*
|
put Total RNA |
Number of cycles |
|
|
Non-stranded |
Stranded |
|
|
10 ng |
15 | 15 |
|
100 ng |
14 | 14 |
|
500 ng |
12 | 13 |
|
1 μg |
11 | 12 |
【注】:*由于文库产量不仅与投入量和扩增循环数相关,样本质量、片段化条件、分选条件等都会影响产量。建库过程中请根据实际情况综合考虑,选择最合适的建库条件。
5.DNA磁珠纯化与分选 (Bead-based Clean Up and Size Selection)
■ 建库过程中有多个步骤需要使用DNA纯化磁珠,我们推荐使用DNA Selection Beads (tn Cat#12601)进行DNA纯化和分选。
■ 磁珠使用前应先平衡至室温,否则会导致得率下降、分选效果不佳。
■ 磁珠每次使用前都应充分振荡混匀或使用移液器上下吹打充分混匀。
■ 转移上清时,请勿吸取磁珠,即使微量残留都将影响后续文库质量。
■ 磁珠洗涤使用的80%乙醇应现用现配,否则将影响回收效率。
■ 产物洗脱前应将磁珠置于室温干燥。干燥不充分容易造成无水乙醇残留影响后续反应;过分干燥又会导致磁珠开裂进而降低纯化得率。通常情况下,室温干燥3-5 min足以让磁珠充分干燥。
■ DNA纯化或长度分选产物如需保存,可使用0.1×TE Buffer洗脱,产物于4°C可保存2天,-20°C可保存1个月。
6.关于文库质检 (Library Quality Analysis)
■ 通常情况下,构建好的文库可通过长度分布检测和浓度检测来进行质量评价。
■ 文库浓度检测可使用:基于双链DNA荧光染料的方法,如Qubit®、PicoGreen®等;基于qPCR绝对定量的方法。
■ 推荐使用qPCR方法进行文库浓度检测:Qubit®等基于双链DNA荧光染料的浓度测定方法时,无法有效区分单端连接Adapter的产物、两端均未连接Adapter的产物及其他不完整双链结构产物;qPCR绝对定量基于PCR扩增原理,仅定量样品中两端Adapter完整的文库(即可测序的文库),可排除单端或双端都不连接Adapter的不可测序文库的干扰。
■ 文库浓度检测不可使用:基于光谱检测的方法,如NanoDrop®等。
■ 文库长度分布检测,可通过Agilent Bioanalyzer 2100等基于毛细管电泳或微控流原理的设备进行检测。
操作流程